معنی کلمه جدول تناوبی در دانشنامه عمومی
جدول تناوبی با نام دیمیتری مندلیف شناخته شده است، با اینکه پیشروان دیگری پیش از او وجود داشته اند. او جدولی مشابه جدول تناوبی امروزی را در سال ۱۸۶۹ منتشر کرد. این، نخستین جدولی بود که به این گستردگی مرتب شده بود. مندلیف این جدول را تهیه کرد تا ویژگی های دوره ای آنچه که بعدها «عنصر» نام گرفت را بهتر نشان دهد. وی توانسته بود برخی ویژگی های عنصرهایی که هنوز کشف نشده بود را پیش بینی کند و جای آن ها را خالی گذاشته بود. کم کم با پیشرفت دانش، عنصرهای تازه ای شناسایی شد و جای خالی عنصرها در جدول پُر شد. با شناسایی عنصرهای نو و گسترش شبیه سازی های نظری دربارهٔ رفتار شیمیایی مواد، جدول آن روز مندلیف بسیار گسترده تر شده است.
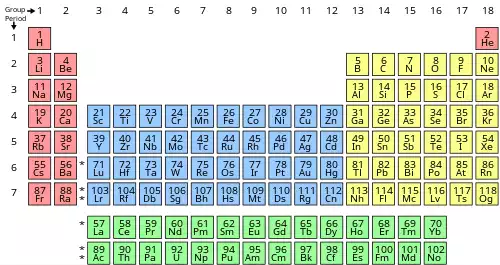
همهٔ عنصرهای شیمیایی از عدد اتمی ۱ ( هیدروژن ) تا ۱۱۸ ( اوگانسون ) شناسایی یا ساخته شده اند. دانشمندان هنوز به دنبال ساخت عنصرهای پس از اوگانسون هستند و البته این پرسش را پیش رو دارند که عنصرهای تازه تر چگونه جدول را اصلاح خواهند کرد. همچنین ایزوتوپ های پرتوزای بسیاری هم در آزمایشگاه ساخته شده است.
همهٔ نسخه های جدول تناوبی تنها دربردارندهٔ عنصرهای شیمیایی هستند و مخلوط، ترکیب یا ذرهٔ زیراتمی در آن ها جایی ندارد. [ پ ۱] هر عنصر شیمیایی یک عدد اتمی یکتا دارد و این عدد برابر با شمار پروتون ها در هستهٔ اتم آن عنصر است. اتم های گوناگون یک عنصر می توانند شمار نوترون های متفاوتی داشته باشند. در این حالت به آن ها ایزوتوپ گفته می شود. برای نمونه کربن سه ایزوتوپ طبیعی دارد. همهٔ ایزوتوپ های کربن ۶ پروتون، و بیشتر آن ها ۶ نوترون دارند؛ اما یک درصد آن ها ۷ نوترون و شمار بسیار کمتری از آن ها ۸ نوترون دارند. ایزوتوپ ها در جدول تناوبی به صورت جداگانه، نمایش داده نمی شوند؛ بلکه میانگین آن ها به عنوان جرم اتمی در زیر عنصر درج می شود. برای عنصرهایی که هیچ ایزوتوپ پایداری ندارند، جرم اتمی پایدارترین یا متداول ترین ایزوتوپ آن ها درون پرانتز نوشته می شود.