پیوند هیدروژنی
معنی کلمه پیوند هیدروژنی در دانشنامه عمومی
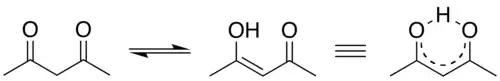
این پیوند درون ترکیباتی دیده می شود که هم هیدروژن و هم عناصر با الکترونگاتیوی بالا ( مانند:اکسیژن، نیتروژن، فلوئور ) وجود داشته باشد.
انرژی پیوند هیدروژنی تقریباً ۲۰ کیلوژول بر مول است؛ بنابراین، پیوند هیدروژنی، ضعیف تر از پیوندهای کووالانسی یا یونی که حدود چند صد کیلوژول بر مول انرژی دارند، می باشد اما از جاذبه های موقت با دامنهٔ کوتاه که به نیروهای واندروالس معروفند - با انرژی تقریبی ۴ کیلو ژول بر مول - قوی تر می باشد؛ بنابراین، پیوند هیدروژنی مسئول بسیاری از خواص منحصر به فرد آب در مقایسه با مولکول هایی با اندازهٔ مولکولی یکسان است.
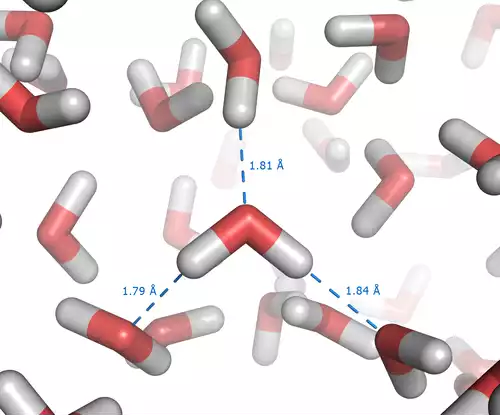
هنگامی که مولکول های آب در کنار هم جا می گیرند، میان اتم اکسیژن از یک مولکول ( که جزئی بار منفی دارد ) و اتم هیدروژن از مولکول دیگر ( که جزئی بار مثبت دارد ) نوعی کشش یا پیوند «الکترواستاتیکی» شکل می گیرد که همان پیوند هیدروژنی است.
به دلیل نظم تقریباً ۴ وجهی الکترون ها پیرامون مولکول آب، هر مولکول آب به طور بالقوه می تواند با ۴ مولکول آب دیگر پیوند هیدروژنی برقرار کند. همین پیوند هیدروژنی میان مولکول های آب، موجب پیوستگی سطحی شدید روی آب مایع شده است.
پیوند هیدروژنی موجب ویژگی های شگفتی در آب شده است. برای نمونه:
• بالا بودن ظرفیت گرمایی
• بالا بودن گرمای نهان تبخیر
• افزایش حجم غیرعادی در مقابل کاهش دما ( از ۰ تا ۴ - درجه سانتی گراد )
پیوند هیدروژنی علاوه بر ایجاد واکنش بین مولکول های آب، مسئول جاذبهٔ بین مولکول های آب با سایر مولکول ها یا سطوح است. به عنوان مثال، پیوند هیدروژنی اساس تشکیل لایه آبی است که در اطراف ماکرومولکول های مهم بیولوژیکی نظیر پروتئین ها، اسیدهای نوکلئیک و کربوهیدرات ها وجود دارد. این لایه ها به طور محکم پیوند برقرار کرده و به شدت آرایش یافته اند، اغلب به آب پیوندی Bound water معروفند. برآورد شده است که آب پیوندی ۳۰ درصد وزن خشک مولکول های پروتئین هیدراته را تشکیل می دهد. آب پیوندی برای پایداری مولکول های پروتئین مهم است. آب پیوندی لایه ای ضربه گیر در اطراف پروتئین ایجاد می کند که مانع از نزدیکی زیاد مولکول ها و در نتیجه ( مانع از ) توده ای شدن و رسوب آن ها می شود. در آب شناسی آب پیوندی لایه بسیار نازکی است که مواد معدنی را احاطه می کند.
معنی کلمه پیوند هیدروژنی در ویکی واژه
جملاتی از کاربرد کلمه پیوند هیدروژنی
الکلها در میان هیدروکربنهای هم وزن خود دمای جوش بالاتری دارند که آن را میتوان به پیوند هیدروژنی الکلها دانست.[نیازمند منبع]
داده شده به حضور در مارپیچهای آلفا و صفحات بتا از لحاظ آماری است، و برای پذیرفتن یا نپذیرفتن یک الگو بر اساس میزان مناسب بودن آن، یک آستانه در نظر گرفتهمیشود. انتخاب تنها یک آستانه آن هم برای ترکیب کمیتهای هر الگوی دارای پیوند هیدروژنی به جای در نظر گرفتن چند آستانه (برای ترکیبهای مختلف کمیتها) این اجازه را میدهد تا پارامترهای تشخیص با دقت بیشتری تعیین شوند؛ چرا که الگوهای دارای زوایای پیچشی نامناسب، در صورتی که پیوندهای هیدروژنی قوی داشته باشند قابل قبول هستند و برعکس، پیوندهای هیدروژنی نسبتاً ضعیف با زوایای صحیح زنجیرهٔ اصلی قابل جبران شدن هستند.