ایزوتوپ
معنی کلمه ایزوتوپ در فرهنگستان زبان و ادب
معنی کلمه ایزوتوپ در دانشنامه عمومی
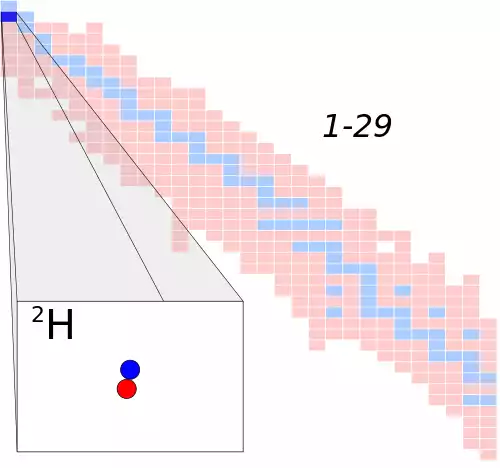
در توضیح دیگر: ایزوتوپ به عنصر شیمیایی می گویند که در اتم خود، تعداد پروتون و الکترون یکسان و تعداد نوترون متفاوت داشته باشد. به عبارت دیگر، ایزوتوپ ها عناصری هستند که تنها در تعداد نوترون هایشان با یکدیگر متفاوت باشند. به طور مثال، کربن - ۱۲، کربن - ۱۳ و کربن - ۱۴، همگی ایزوتوپ های کربن به شمار می آیند. عدد اتمی یا تعداد پروتون ها ( در کربن برابر ۶ ) مانند سایر عناصر همواره عددی ثابت است در حالی که کربن - ۱۲ در مجموع ۶ نوترون، کربن - ۱۳ در مجموع ۷ نوترون و کربن - ۱۴ در مجموع ۸ نوترون دارد. بدین ترتیب عدد جرمی ( تعداد پروتون ها و نوترون ها ) ایزوتوپ های کربن به ترتیب ۱۲، ۱۳ و ۱۴ است.
نام گذاری یک ایزوتوپ به صورت نام عنصر مورد نظر، خط فاصله و عدد جرمی آن ایزوتوپ انجام می شود ( برای نمونه هیدروژن - ۲ ( دوتریوم ) و اورانیوم - ۲۳۵ ) . هنگامی که از نمادهای شیمیایی استفاده شود، عدد اتمی به صورت زیرنویس و عدد جرمی به صورت بالانویس، هر دو پیش از نماد عنصر نوشته می شوند ( مانند O۱۸۸ ) . البته با توجه به این که نماد یک عنصر، معرف عدد اتمی آن نیز هست؛ معمولاً تنها عدد جرمی نشان داده می شود ( مانند O۱۸ ) . گاهی حرف m نیز به عدد جرمی افزوده می شود که نشان دهندهٔ ایزومر بودن آن ایزوتوپ است ( مانند Tc۹۹m ) .
ایزوتوپ پایدار به عنوان ایزوتوپی تعریف می شود که تاکنون هیچ شکلی از واپاشی آن مشاهده نشده است. اگر نسبت نوترون به پروتون عنصر کمتر از یک و نیم باشد عنصر بدون واپاشی و پرتوزایی است. تاکنون ۲۵۴ ایزوتوپ پایدار شناسایی شده اند که مربوط به ۸۲ عنصر اول جدول تناوبی ( به جز تکنسیم و پرومتیم ) هستند. البته پیش بینی می شود که تنها ایزوتوپ هایی از ۴۰ عنصر اول ( شامل ۹۰ ایزوتوپ ) ، نسبت به همهٔ شکل های واپاشی پایدار باشند و سایر ایزوتوپ هایی که اکنون به عنوان ایزوتوپ پایدار خوانده می شوند، در مقابل شکلی از واپاشی، ناپایدار باشند که تاکنون مشاهده نشده است.
معنی کلمه ایزوتوپ در دانشنامه آزاد فارسی
هریک از دو یا چند اتم با عدد اتمییا تعداد پروتونیکسان، و جرم اتمیمتفاوت. در این حالت، تعداد نوترون۴های این اتم ها با هم تفاوت دارد (← جرم اتمی نسبی). ایزوتوپ ها ممکن است پایداریا پرتوزاباشند (← پرتوایزوتوپ)، در طبیعت وجود داشته باشند، یا مصنوعاً تولید شوند. مثلاً، هیدروژن علاوه بر ایزوتوپ پایدار۱H دارای ایزوتوپ های ۲H(دوتریوم) و ۳H(تریتیوم) است. این اصطلاح را شیمی دان انگلیسی، فردریک سودی، پژوهشگر پیشگام در زمینۀ فروپاشی اتمی، وضع کرد. عناصری که در انتها و پایین جدول تناوبیقرار دارند، اتم هایی با تعداد پروتون و نوترون های تقریباً یکسان هستند. به این عناصر ایزوتوپ های پایدارمی گویند. ایزوتوپ های پایدار اُکسیژن عبارت اند از ۱۶O، ۱۷O، ۱۸O و ایزوتوپ های پایدار کربُنعبارت اند از ۱۲C و ۱۴C. در عناصری با جرم اتمی زیاد، تعداد نوترون بسیار بیشتر از تعداد پروتون هاست و به همین سبب پایداری کمتری دارند. این ایزوتوپ ها بیشتر از طریق پرتوزایی در معرض واپاشی اند. دو نمونه از این ایزوتوپ ها عبارت اند از ۲۳۸U (اورانیومِ۲۳۸) و ۶۰Co (کبالتِ۶۰). در شتاب دهندۀ سیکلوترونی، با استفاده از هدف چرخانی که با آب خنک می شود، ایزوتوپ تولید می کنند. ایزوتوپ های تولید شده عبارت اند از گالیومِ۶۷، با نیم عمر۷۸ ساعت، و ایندیومِ۱۱۱، با نیم عمر ۶۷ ساعت. با تابش دهی گسترده به مدت ۱۵۰ ساعت، می توان سدیومِ۲۲، کبالتِ ۵۷، و کادمیومِ۱۰۹ نیز تولید کرد که نیم عمر همۀ آن ها بیش از ۱۵۰ ساعت است.
جملاتی از کاربرد کلمه ایزوتوپ
فراوانترین ایزوتوپ این عنصر، هیدروژن-۱ یا پروتیم یا هیدروژن سبک است. این ایزوتوپ هیچ نوترونی ندارد. ( تنها اتم بدون نوترون و پایدار ) دیگر ایزوتوپهای هیدروژن مانند دوتریوم، نوترون بیشتری دارد. رابطههایی که در پایین آورده شدهاست برای هر سه ایزوتوپ هیدروژن کار میکند. تنها مقدار ثابت ریدبرگ گوناگون است و برای هر ایزوتوپ باید اصلاح شود.
در فراکافت کنشوری نوترونی، نمونه به وسیلهٔ نوترون بمباران شده و به یکی از ایزوتوپهای پرتوزا تبدیل میشود. با توجه به نشر پرتو و نوع واپاشی هستهای، میتوان به نوع عنصر پی برد. با اطلاعات بدست آمده از طیفهای نشری، غلظت عنصر قابل اندازهگیری خواهد بود.
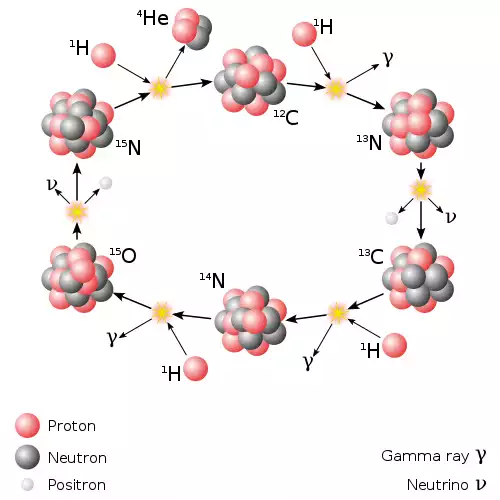
پروتونها و نوترونهای باقیمانده، در فرایندی به نام هستهزایی (سنتز هستهای) شروع به واکنش با یکدیگر و تشکیل ایزوتوپهای هلیم و هیدروژن و مقادیر اندکی لیتیم نمودند. این فرایند پس از حدود ۵ دقیقه به اوج رسید.
۴. بررسی ترکیب شیمیایی، ایزوتوپیک و معدنی سطح مریخ و مواد مربوط به زمینشناسی سطح.
در این روش از رادیوایزوتوپهایی استفاده میشود که ذرات گاما از خود ساطع میکنند.
کاربرد ایزوتوپ اکسیژن ۱۸ در علوم پزشکی جهت تشخیص بیماریها با استفاده از تکنیک تشخیصی پت اسکن یا برش نگاری با نشر پوزیترون، به توسعه یکی از دقیقترین روشهای تشخیص سلولهای سرطانی در ابتداییترین مراحل رشد منجر شدهاست. همچنین اندازهگیری ایزوتوپهای اکسیژن در مطالعات هیدرولوژی آبهای زیرزمینی، چگونگی حرکت و توزیع آبها در سفرههای آبی کاربرد دارد. مطالعات ایزوتوپی هیدرولوژی اطلاعات تکمیلی از نوع، سرچشمه و سن آبهای زیرزمینی ارائه میدهند.
آب سبک، آبی است که نسبت ایزوتوپ دوتریوم در آن از حد آب معمولی کمتر است.
در انسان، دوزهای خوراکی ۱۵۰–۱۵ میلیگرم ادوکسابان ۱–۲ ساعت پس از مصرف به بیشینه غلظت خود در خون میرسد. با دوزهای ۶۰ میلیگرمی از ایزوتوپ نشاندار ادوکسابان، ۹۷ درصد از کل تابش پس از تجویز خوراکی، ۶۲ درصد از مدفوع و ۳۵ درصد از ادرار شناسایی شد. ۴۹٪ از کل تشعشعات مدفوع و ۲۴٪ از ادرار از ادوکسابان و بقیه از متابولیتهای آن بود.
طیفسنجی جرمی نوعی نمودار سیگنال یونی است که تابعی از نسبت جرم-به-بار است. این طیفها جهت تعیین امضای عنصری یا ایزوتوپی یک نمونه مورد استفاده قرار میگیرد که جرم ذرات و مولکولها بوده و همچنین جهت تعیین هویت شیمیایی یا ساختاری مولکولها و سایر ترکیبات شیمیایی از آن استفاده میشود.
این ایزوتوپ ابتدا فرض شده بود و سپس توسط پاتریک بلاکت در آزمایشگاه رادرفورد ۱۹۲۴ تصویربرداری شد.